凡例:*1…注釈番号 1)…参考文献番号
執筆者
粂 昭苑(東京工業大学 生命理工学院 教授)
![]() プロフィール
プロフィール
東京大学薬学部卒、同薬学修士、帝人(株)研究員を経て、大阪大学理学系研究科博士課程に進学。その後、ERATO研究員として一貫して初期形態形成についての研究に従事した。1999年より3年間、ハーバード大学留学を転機に、多能性幹細胞から膵臓の発生分化研究に取り組んでいる。 2014年から現職。
![]() 休日の過ごし方
休日の過ごし方
運動不足を解消するため、休日はスポーツジムで泳ぐようにしている。
![]() 研究室のホームページ
研究室のホームページ
http://www.stem.bio.titech.ac.jp/
はじめに
1型糖尿病の根治療法として、膵臓移植・膵島移植が保険適用となっています。しかし移植医療にはドナー不足が大きな問題点として挙げられ、その問題を解決するために、幹細胞を用いた研究が期待されています。
ヒトES細胞(Embryonic Stem cell)とiPS細胞(induced Pluripotent Stem cell)は、卵のように体のどんな細胞にも分化*1する能力を持つ多能性幹細胞です。近年、これらの多能性幹細胞から様々な分化細胞を作製し、再生医療へ応用する機運が高まってきています。多能性幹細胞から私たちの体に存在する膵島細胞と同程度の機能を持つ細胞を作ることができれば、人から人への移植医療に代わる手法として利用することができます。糖尿病の再生医療に使用できる細胞の作製とその利用については世界中で多くの研究グループによって進められています
*1 分化:特定の働きをもつ細胞になること
ヒト多能性幹細胞のES/iPS細胞からの膵島作成の基礎およびこれまでの発展経緯
私たちの体内では膵島細胞がどのようにしてできてくるのかをという過程を知り、その膵島の発生*2分化の過程と同じことを試験管内で再現させることにより、多能性幹細胞から膵島細胞を作製することができます。正常な発生過程において作用する成長増殖因子を順番に培養下の細胞に加えてあげることにより、発生過程を模倣した形で、ヒトES・iPS細胞から内胚葉*3、膵前駆細胞*4、内分泌前駆細胞、そしてインスリン産生細胞へと、順番に分化させる方法が取られています(図1)。
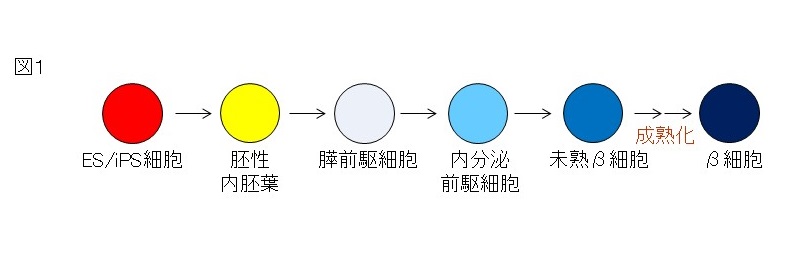
図1: ES/iPS細胞から膵臓β細胞への分化誘導
発生過程を模倣した形で、ヒトES・iPS細胞から内胚葉、膵前駆細胞、内分泌前駆細胞、そしてインスリン産生細胞へと、順番に分化させる方法
ヒトES細胞を用いた分化誘導研究が始まった当初(2000年頃)、胚様体という3次元の構造体を形成し、自然誘発的に分化させた手法がとられましたが、効率は低いものでした。その後、2次元培養下で成長増殖因子を順番に加えるアプローチが取られるようになり、分化誘導*5効率が改善されました。米国バイオテク企業のViacyteから、ヒトES細胞から胚性内胚葉を経てインスリンを産生する膵β細胞を分化誘導することに成功したなど、いくつかの重要な報告がなされました。2008 年には,ヒトES細胞から未熟な膵前駆細胞まで作成し、マウス体内でさらに成熟させることで機能的なインスリン陽性細胞*6になったと報告されました1)。しかし、移植された細胞はマウスの体内で機能を持つインスリン産生細胞まで成熟するためには3か月程度かかる、という問題点がありました。体内の環境下で膵β細胞への成熟化を行うという戦略がとられていたのは、試験管内で分化誘導するだけでは糖応答性*7を示す成熟した細胞を作ることが難しかったためであり、ヒトES/iPS細胞から前駆細胞まで分化誘導し、それをマウスへ移植してマウス体内の環境を借りて、成熟させるのでした。また、それぞれの分化誘導ステップに加える成長増殖因子は高価なため、コスト削減の観点から成長増殖因子を化合物に置き換える試み、そして分化を促進する化合物の探索がなされました2–4)。
2014年には、ヒトES細胞由来の成熟した膵β細胞を作製したとする論文が2つ報告されました5)6)。Pagliucaらは、それまでの2次元の分化培養法から3次元培養の手法へ転換し、約70の化合物を含む150以上の組み合わせについて検討し、成長因子の種類や添加時期を改良することでヒト膵島のインスリン分泌能*8に非常に近い膵β細胞を誘導しました5)。Rezania らは、マウス胚*9を用いた研究で膵臓成熟化に効果があると報告されていた気相-液相境界培養法*10を培養後半に導入しました。彼らは、R428というMAFA*11の発現*12を上昇させる分化促進化合物を同定したことで、最終的には約50%の細胞がインスリン陽性となり、糖に応答したインスリン分泌を示したと報告しました6)。彼らにより、作製されたヒトES細胞由来の膵β細胞はマウス体内へ移植したのち、短期間で糖応答性インスリン分泌を示し、糖尿病モデルマウスの高血糖を治療することができたことが示されました。しかし、インスリン分泌の詳細な解析から、作成した膵β細胞はヒト膵島に比べると血糖上昇に対するインスリン分泌反応が遅く、培養条件のさらなる最適化がその後も続けられてきました。その試みにより、分化細胞の解離と再凝集が成熟化に有効であると報告されました。内分泌前駆細胞が膵島の構造を形成するために、細胞が回りの膵上皮から集まり立体構造を取ることが重要と考えられ、試験管内ではiPS細胞から分化させた細胞をいったん解離させ、純化した後に再凝集させることで、飛躍的に成熟度が向上したことが示されました7)。また、2次元培養下では機能を示す細胞になるための成熟化が難しいとされていましたが、それは細胞外環境と細胞とが相互作用することによって成熟化の制御がなされるためと説明され、細胞骨格*13に作用する化合物により成熟化させることができることが報告されました8)。
*2 発生:卵が成体に達すること。その過程。
*3 内胚葉:のちに消化管の主要部分や呼吸器などが形成される部分
*4 膵前駆細胞:膵臓の細胞になる前段階の細胞
*5 インスリン陽性細胞:インスリンの抗体で染まった、インスリンタンパク質を作 る能力を持つ細胞(インスリン産生細胞よりも未熟な状態の細胞から当てはまる)
*6 分化誘導:幹細胞が何らかの刺激を受けて異なる細胞になる過程を引き起こすこと
*7 糖応答性:血糖値に応じて正常にインスリンを分泌する性質
*8 インスリン分泌能:インスリンを分泌する能力
*9 胚:卵の中で発生をはじめたばかりの幼生物。
*10 気相-液相境界培養法:膜の上に組織塊を置き、それを培養液に浮かせて培養する方法、あるいは、カルチャーインサートの外にだけ培養液を入れて培養方法。組織塊は上に空気に接し、膜を介して液に触れる培養方法。例えば消化器官の細胞は、空気に接している状態のほうが細胞にとって良い環境の場合には、このような培養方法を取る。
*11 MAFA:膵臓β細胞におけるインスリン遺伝子の転写(遺伝子の情報をもとにタンパク質を作る過程のうちRNAという物質を作ること)を促進する転写因子。
*12 発現:遺伝子の情報をもとにタンパク質を合成すること
*13 細胞骨格:細胞内に存在し、細胞の形態を維持し、また細胞内外の運動に必要な物理的力を発生させる細胞内の繊維状構造。細胞自身の変形を行う際に重要な細胞小器官。
国内外の研究開発の現状
これまでの膵臓発生分化の仕組みはマウスを用いた研究によって明らかにされてきました。しかし、ヒト多能性幹細胞から得られた分化細胞がヒトの膵島細胞に近づくに従い、新しい技術を駆使した分化細胞の解析により、これまで未解明であったヒト膵島の発生分化の仕組みを知ることができるようになってきました。例えば、分化細胞は均一な集団ではない(インスリン分泌をするβ細胞と増殖性 のβ細胞が混在している)ことから、単一な細胞(ここではβ細胞)について網羅的な遺伝子発現解析を行えば、どのような細胞集団からなるかが推定できます。分化途中から複数のタイミングで細胞を回収し、時間軸に沿って得られた細胞について、個別の細胞の遺伝子発現の膨大なデータを解析することで、細 胞の運命追跡が可能となります。このような手法により、分化誘導方法の検証、分化に関わる遺伝子を新たに見つけることも可能となります9)。ヒト膵島がどのように作られるのかということの理解は、ヒト多能性幹細胞から私たちの体にある膵島細胞を作るためには大変重要となります。
今後の展望と課題
近年、多能性幹細胞から膵島細胞を作る研究が飛躍的に進歩しました。ヒト膵島細胞に近い細胞が得られるようになってきたものの、いくつかの重要な遺伝子の発現が実際のヒト膵島細胞とは異なり、糖応答性インスリン分泌能において、ヒト膵島細胞との相違が依然として存在します。これらの問題点をどのように解消できるか、が今後の研究において重要となります。
多能性幹細胞から膵島細胞の作製と並行して、臨床応用に向けた取り組みとして、安全性の確保は当然ながら重要ですが、多くの患者に適用できるような移植手法の開発が進められています。例えば、体の免疫システムから攻撃されないように遺伝子編集技術を用いてヒトiPS細胞を改変することや、免疫細胞が攻撃できないように膵島細胞を保護できるようなデバイス(膜)を開発することなどが進められており、今後の研究の進展が望まれています。
参考文献
- Kroon, E. et al. Pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells in vivo. Nat. Biotechnol. 26, 443–452 (2008).
- Ghazizadeh, Z. et al. ROCKII inhibition promotes the maturation of human pancreatic beta-like cells. Nat. Commun. 8, (2017).
- Chen, S. et al. A small molecule that directs differentiation of human ESCs into the pancreatic lineage. Nat. Chem. Biol. 5, 258–65 (2009).
- Sakano, D. et al. VMAT2 identified as a regulator of late-stage β-cell differentiation. Nat. Chem. Biol. 10, 141–8 (2014).
- Pagliuca, F. W. et al. Generation of Functional Human Pancreatic β Cells In Vitro. Cell 159, 428–439 (2014).
- Rezania, A. et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotechnol. 32, 1121–1133 (2014).
- Nair, G. G. et al. Recapitulating endocrine cell clustering in culture promotes maturation of human stem-cell-derived β cells. Nat. Cell Biol. 21, 263–274 (2019).
- Hogrebe, N. J., Augsornworawat, P., Maxwell, K. G., Velazco-Cruz, L. & Millman, J. R. Targeting the cytoskeleton to direct pancreatic differentiation of human pluripotent stem cells. Nat. Biotechnol. 38, 460–470 (2020).
- Veres, A. et al. Charting cellular identity during human in vitro β-cell differentiation. Nature (2019). doi:10.1038/s41586-019-1168-5

表1:重要な出来事と論文の発表年度
おすすめの書籍や文献など
「iPS細胞が医療をここまで変える-実用化への熾烈な世界競争」山中伸弥 PHP新書2016年