凡例:*1…注釈番号 1)…参考文献番号
執筆者
中神啓徳(大阪大学大学院医学系研究科健康発達医学寄附講座教授)
![]() プロフィール
プロフィール
岐阜県生まれ、岐阜高校卒業。1994年に奈良県立医科大学を卒業後、自治医科大学内科および循環器内科、大阪大学医学部、愛媛大学医学部を経て、2001年から米国ハーバード大学医学部で研究に従事。帰国後、大阪大学大学院医学系研究科遺伝子治療学助手(助教)を経て、2000年より連合小児発達学研究科健康発達医学寄附講座教授、2005年より現職。
![]() 休日の過ごし方
休日の過ごし方
体重増加を防ぐために、休日は少し長めの長時間のジョギングをして運動不足解消を心がけています。
![]() 研究室のホームページ
研究室のホームページ
http://www.cgt.med.osaka-u.ac.jp/vme/
はじめに
遺伝子治療は、現在の医療では治療法のない病気に対して効果が期待される新しい治療法です。具体的には、生まれつき酵素が不足しているために将来にわたり薬の補充が必要な遺伝性疾患に対し、遺伝子治療を行うことにより長期間体内で酵素を補充する治療が実現できるようになってきました。また、一時的に遺伝子を生体あるいは細胞で発現*1させることにより、悪性のがんの治療や難治性の血管疾患に対する治療もヒトで実施されるようになってきました。
長い年月をかけて遺伝子治療が特別な治療法から、少しずつその適応が拡大される方向で議論されるようになってきています。
*1 発現:遺伝子をもとにタンパク質を作り出すこと
遺伝子治療の現状
遺伝子治療がおこなわれた年度別の数を見てみると、1990年代は右肩上がりに上昇し、1999年には100例を超えました。しかしそれ以降は年間100例程度という横ばいの状態が約15年間続きました(図1)1)。その間にベクター*2の安全性の問題が問われる問題が2回起こりました。1999年にアメリカのペンシルベニア州でおこなわれた遺伝子治療の際、死亡事故が起きたのです。このときアデノウイルスベクターを用いて治療がおこなわれましたが、このウイルスベクターの副作用が死因につながったと考えられました2)。この遺伝子治療は、死者が出たことをきっかけに中断されました。その後の調査で、治療の途中におこなわれた検査結果で中止すべき数値が出ていたにもかかわらず、治療を継続していたという事実が明らかになりました。この事件を契機にベクターの安全性の問題に加えて、薬を人に投与する研究をおこなう際の体制の見直しが必要であることが明らかになりました。
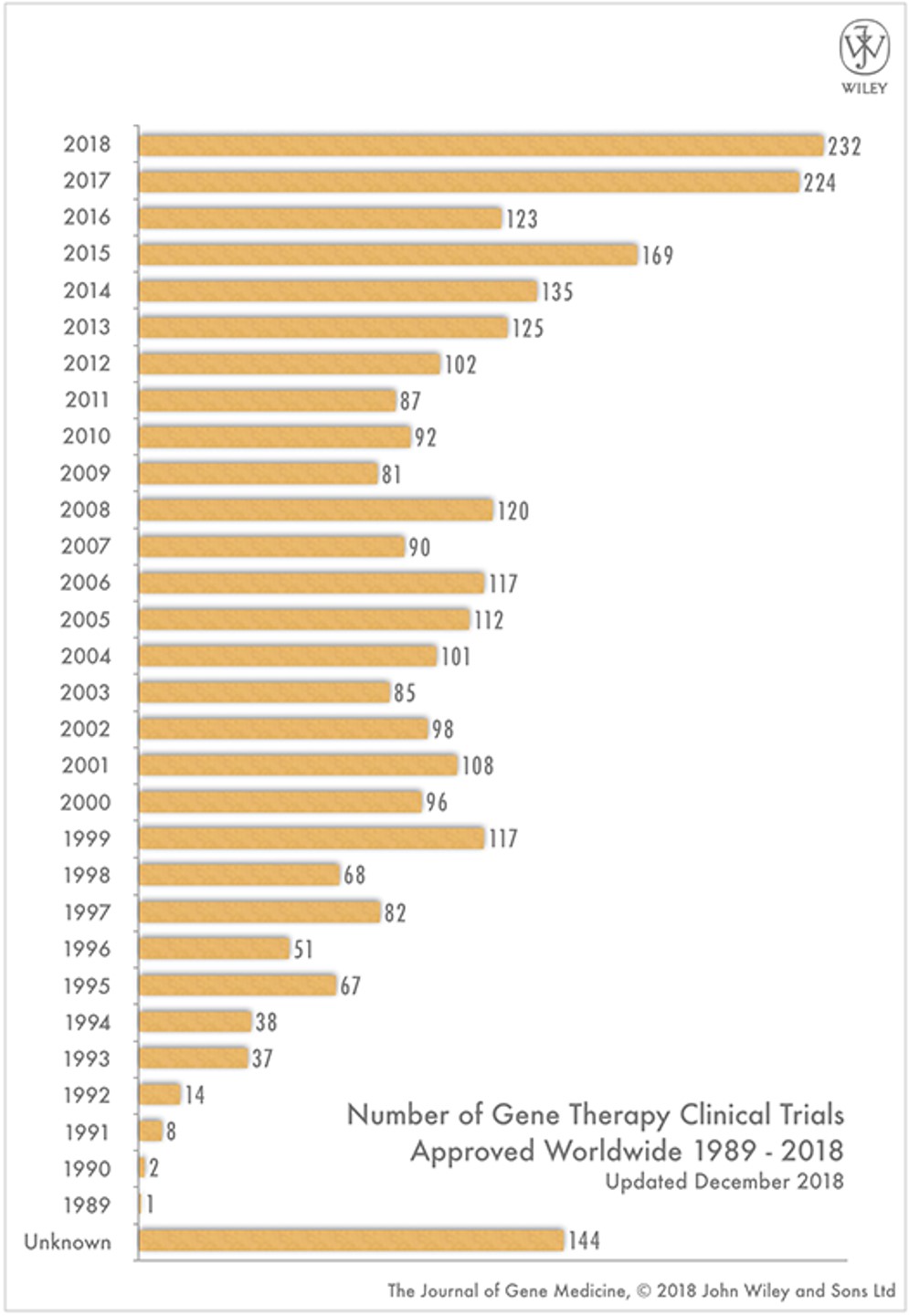
図1 世界での遺伝子治療実施数の年別推移
2002年には、フランスでX-SCID(X-linked severe combined immunodeficiency)という免疫不全の病気に対する遺伝子治療がおこなわれ、その治療により白血病を発症したことが報告されました3)。この治療は、新生児あるいは乳幼児に対して、レトロウイルスベクターを用いて、生まれつき不足している遺伝子を骨髄細胞に導入する遺伝子治療です。このとき、白血病を発症した患者さんでは、癌を進行させる遺伝子が活性化されていました。すなわち、レトロウイルスベクターによって必要ではない遺伝子を発現させてしまったのです。結果として癌を誘発させることになりました。その後の分析により、この患者さんではがんに関連する遺伝子が活性化されたことに加えて、生まれつき遺伝子が不足していることが原因で、免疫機能が低下していたこともわかりました。体内で発生した異常細胞(がん細胞)を、自らの免疫機構で排除できず、白血病が発症したと考えられます。
このように事例を分析することにより、有効性だけでなく安全性も高めながらその技術を成熟させたことが実を結び、2012年に欧州で初めて承認された治療薬がリポタンパクリパーゼ発現アデノ随伴ウイルスベクター(商品名Glybera)です。これは、家族性リポタンパクリパーゼ欠損症の患者さんの筋肉に遺伝子を投与する治療法です。続いて、2015年には治療薬として腫瘍溶解性ヘルペスウイルス(商品名Imlygic)が米国・欧州で承認されています。腫瘍溶解性ウイルスは、がんに対して有効な治療法として開発されたもので、正常細胞では増えず、腫瘍細胞(がん細胞)だけで増えて細胞死を誘導する遺伝子です。その後も酵素を補充する治療法や白血病に対する複数の治療薬製品が承認されています。承認された治療薬が出来てきて、治療法の可能性が広がったことから、この数年は開発数が増加傾向に転じています。
*2 ベクター:遺伝子を細胞の中に運ぶための運ぶための担い手
1型糖尿病をターゲットにした遺伝子治療
健康な人の場合は膵臓のβ細胞でインスリンがつくられていますが、1型糖尿病の患者さんはβ細胞が破壊されていてインスリンをつくることができません。そこである特定の遺伝子を導入し、①「インスリン遺伝子を導入*3し、インスリン分泌能を復活させる」遺伝子治療が検討されています。さらに、1型糖尿病は、自らが膵臓のβ細胞を攻撃する自己免疫疾患ですので、②「遺伝子治療により自己免疫機構を抑えて膵臓のβ細胞を守る」ことも検討されています。
以下、この二つの取り組みについて説明します。
①インスリン遺伝子を導入し、インスリン分泌能を復活させる
インスリンが絶対的に不足している1型糖尿病に対して、インスリンの体内での産生を期待してインスリン遺伝子を導入することは非常に直接的な方法です。元々インスリンが産生されている膵臓のβ細胞にインスリン遺伝子を直接導入することが理想ですが、膵臓は身体の奥にある臓器で解剖学的にアプローチが難しいこと、膵臓のβ細胞自体の数が少ないことなどから現実的には難しい治療法です。そのため、膵臓以外の細胞にインスリン遺伝子を導入し、インスリンを分泌させることが検討されています。最もよく研究されているのは肝細胞です。肝細胞が使われるのは、肝細胞はつねに高濃度のインスリンにさらされている細胞であるため、正常に近いインスリンの作用動態が期待できるからです。また肝細胞ではグルコースの濃度センサーであるグルコースキナーゼ(GK)の遺伝子を発現しているため、膵β細胞のように、グルコースの濃度によってインスリンを調整することができることも理由としてあげられます。
しかし一方、インスリンの活性化(プロインスリンのプロセシング)に必要な遺伝子が肝臓では発現していないという問題点があります。インスリンは膵β細胞で分泌されますが、初めからインスリンとして分泌されるわけではなく、プロインスリンという物質が作られた後に活性化(プロセシング)されることで最終的にインスリンとなるため、プロセシングの工程が欠かせないのです。この問題を解決するために、インスリン遺伝子を改造して肝臓でもプロセシングされるような変異型インスリンを導入する方法などが動物実験で試みられています4)。
もう一つの大きな問題は、インスリン分泌量の調節システムをつくるのが難しいことです。健康な人の膵臓のβ細胞では食後の血糖の増加に反応して素早くインスリンの生合成量が変化し、非常に厳密にインスリンの分泌が調節されています。インスリン遺伝子を導入した肝臓の細胞でこのシステムを構築することは非常に困難です。すなわち、一定の基礎値を保ちながら、食後グルコース濃度が高くなると瞬時に反応してインスリン分泌量が増加するという緻密なインスリン分泌量の調節システムは、膵臓のβ細胞に備わる特殊な機能で、現在のところ、これを再現することはできません。この問題を克服するために、グルコース濃度に依存して活性が調節されるプロモーター*4を利用することも試みられています5)。健康な人と同じような緻密な調節システムを構築することは、まだ非常に困難であるのが現状です。
*3 導入:遺伝子を細胞に入れること
*4 プロモーター:インスリンの転写(遺伝子情報であるDNAを読み取っていく作業)の開始を調整する遺伝子領域
②遺伝子治療により自己免疫機構を抑えて膵臓のβ細胞を守る
近年、遺伝子治療の技術を用いて、免疫にはたらきかけるような治療法が開発されています。このような遺伝子治療の技術を用いた免疫治療法は、DNAワクチンやRNAワクチン*5などと呼ばれています。現在世界で行われているワクチンに関連する遺伝子治療で、どのような遺伝子を生体に発現させて治療しているかをみてみますと、抗原(Antigen)*6が最も多く用いられていることが分かります(図2)。

図2 遺伝子治療で生体に導入される遺伝子の対応別集計
ワクチンは、外敵に相当する抗原タンパクを生体に投与して免疫反応を引き起こすことにより細菌やウイルスなどと免疫で戦う手助けをするものですが、免疫の仕組みがいろいろと明らかになるにつれて、ワクチンになり得るいろいろな治療法が考えられています。生体の中で抗原を発現させることで、従来のワクチンと同様に細菌やウイルスなどと戦う免疫を得ることができるようになるため、治療法の一つとして遺伝子治療の技術は注目されており、今後も増加傾向にあると思われます。
糖尿病を標的とした免疫治療としてのワクチン開発として、1型糖尿病治療を目指した免疫作用を抑える「免疫寛容*7型」のワクチンが検討されています。1型糖尿病では膵β細胞の傷害(免疫細胞に攻撃されることによる)に伴いGAD65抗体*6の数値が上昇することが知られており、ヒト臨床においても診断マーカー(疾患の診断のために用いる指標)として用いられています。このGAD65を標的としたワクチンによって、免疫の反応性を弱めるタイプの免疫寛容型ワクチンは動物実験で効果が認められ、少数例でのヒト臨床試験においても効果が認められました。そこで、その結果を元にした大規模試験でワクチンの効果が検証されましたが、1型糖尿病患者様のインスリン分泌量に有意な変化を与えることができなかったことから、残念ながらこの治療法の効果は認められないという結論になりました6)。その原因として、GAD65抗体が出現する頃にはすでに膵β細胞の障害によるインスリン分泌能の低下が始まってしまっていることが考えられました。
そこで、さらに早い時期に診断が可能な標的分子として、我々はGlial fibrillary acidic protein(GFAP)というタンパク質に着目した検討を行い、そのタンパク質に対する抗体(抗GFAP抗体)が1型糖尿病モデルマウスおよびヒト糖尿病患者で上昇していることを確認しました7)。引き続き、この免疫治療の可能性の検討は続いています。
*5 DNAワクチン・RNAワクチン:遺伝子情報であるDNA・RNAを用いて細胞の中でタンパク質を作らせて、そのタンパクに対する免疫を誘導するタイプのワクチン
*6 抗原・抗体:抗原とは免疫を誘導する物質であり、体内でそれに対抗して物質として作られるのが抗体です。
*7 免疫寛容:自分由来の細胞や抗原に対しては免疫反応を起こさないような仕組み
参考文献
1)The Journal of Gene Medicine: http://www.wiley.co.uk/wileychi/genmed/clinical/index.html
2)Marshall E: Gene therapy death prompts review of adenovirus vector Science 286: 2244-2245, 1999.
3)Gansbacher B: Report of a second serious adverse event in a clinical trial of gene therapy for X-linked severe combined immunie deficiency (X-SCID). Position of the European Society of Gene Therapy (ESGT). J Gene Med 5: 261-262, 2003.
4)Lee HC, et al. Remission in models of type 1 diabetes by gene therapy using a single-chain insulin analogue. Nature 408: 483-488, 2000.
5)Chen R et al. Auto-regulated hepatic insulin gene expression in type 1 diabetic rats. Mol Ther 3:584-590, 2001.
6)Ludvigsson J, Fares jö M, Hjorth M, Axelsson S, Chéramy M, Pihl M, Vaarala O, Forsander G, Ivarsson S, Johansson C, Lindh A, Nilsson NO, Aman J, Ortqvist E, Zerhouni P, Casas R. GAD Treatment and Insulin Secretion in Recent-Onset Type 1 Diabetes. N Engl J Med. 2008 Oct 30;359(18):1909-20.
7)Pang Z, Higuchi M, Koriyama H, Yoshida S, Kurinami H, Shimamura M, Takami Y, Rakugi H, Morishita R, Nakagami H. Evaluating the potential of the GFAP-KLH immune-tolerizing vaccine for type 1 diabetes in mice. FEBS Lett. 2017 Jan;591(1):129-136.