日本IDDMネットワークが、1型糖尿病の根治実現にむけて大きな期待を寄せるバイオ人工膵島プロジェクト。2019年3月に国立国際医療研究センターに完成した細胞加工施設(CPC)を患者・家族7名が見学し、バイオ人工膵島移植プロジェクトについて霜田雅之膵島移植プロジェクト長に研究の概要をうかがいました。
この研究室訪問と最近(2020年5月時点)の状況を含めてレポートします。

無塵衣に身を包んで患者・家族がCPC内を見学。中央が霜田雅之膵島移植プロジェクト長
霜田先生からのメッセージ
霜田先生のバイオ人工膵島移植にかける想い
ヒトからヒトへの脳死ドナーを使用した膵島移植が、関係者の努力によってようやく保険診療の対象になることができましたが、ドナー不足という問題はどうしても残ります。
ドナー不足を解決するためにバイオ人工膵島移植を日本で実現し、膵島移植を受けられる患者さんの数を増やしたいという想いで、この研究を進めてまいります。
研究室訪問と最近(2020年5月時点)の状況
2020年4月 膵島移植が保険適用に
インスリンを自分の身体で分泌することが出来なくなり、かつインスリン注射を毎日行っていても血糖値が不安定になる、特に低くなりすぎて低血糖発作を起こす患者さんを対象に、膵臓移植と膵島移植という治療があります。
膵臓移植とは、心停止もしくは脳死状態になった方から膵臓を提供していただき、膵臓を血管とつないで移植する方法です。しかし、膵臓移植には、大きな手術が必要で患者さんの負担も大きくなります。そこで新しい技術として、膵臓を臓器の状態で移植するのではなく、インスリンというホルモンを出す細胞(膵島)だけを抽出して移植する「膵島移植」という方法が生まれました。
膵島移植は、肝臓に移植するのが一般的です。門脈という肝臓に注ぐ細い血管の中に膵島を流し込むと、肝臓で生着して、血糖値に合わせてインスリンを出すようになり、血糖値が安定する効果があります。
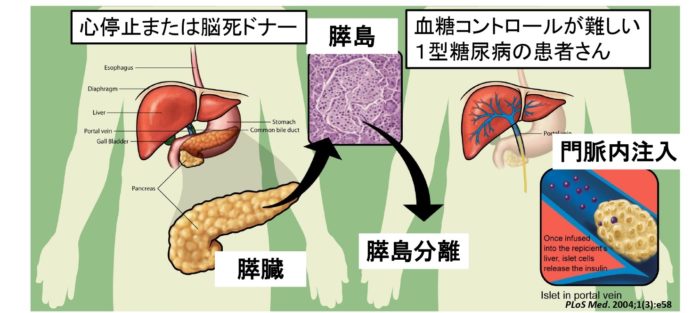
日本ではじめて膵島移植が行われた2004年から2020年3月までの約16年間は、臨床研究として限られた数の患者さんに対して膵島移植が行われてきました。その間の効果が認められ、2020年4月に膵島移植は保険適用が決まりました。この分野では非常に大きな出来事です。
膵島移植の課題「ドナー不足」
膵島移植は、世界で1000例以上行われ、標準治療(科学的な根拠に基づいて、現在利用できる最良の治療法のこと)となった国もあります。これまでの実績から血糖値の安定化、特に低血糖発作を抑制できるという効果があるとわかっています。
しかし大きな課題としてドナー不足があります。日本では、外国に比べてドナーの数は非常に少なく、脳死ドナー数は、1年間で100件未満です。移植に使用できる臓器はさらに絞られますので、多くても数十例しか膵島移植手術が出来ません。一方で、患者さんは何万人もいらっしゃいます。
他にも、移植後は臓器の拒絶反応が起きる可能性が非常に高いので、免疫抑制剤が必要だという問題もあります。
ドナー不足を解決する「バイオ人工膵島移植」
ヒトドナーが少ないため、まずはヒトドナーを増やしていくという努力が社会的には必要ですが、もっと大量に入手できる膵島組織があれば、ヒトドナーの膵島の代わりに移植することが可能になります。
ヒトドナーの膵島の代わりとして、多能性幹細胞(体内の様々な細胞になることができる細胞)と言われているES細胞、iPS細胞でインスリンを出す細胞を人工的に作り移植しようという研究もあります。私たちの研究チームが注目しているのはブタの膵島です。このブタ膵島を用いたブタからヒトという異種膵島移植をバイオ人工膵島移植といいます。
ブタは人間と同じ哺乳動物で、人間と同じように膵島からインスリンを分泌して、血糖値を一定に保っています。
ブタのインスリンは人間のインスリンととても良く似ており(下図参照)、人間にも効果を発揮します。人工的に作り変える必要がありません。家畜ですので繁殖力が強く、比較的安価に大量に入手することができます。ブタの膵島は、サイズ・機能がヒトと似ており、過去にはブタインスリンが1型糖尿病の患者さんの治療薬として使用されていました。現在、世界中で研究されている異種膵島移植は、ほとんどブタを使用しています。
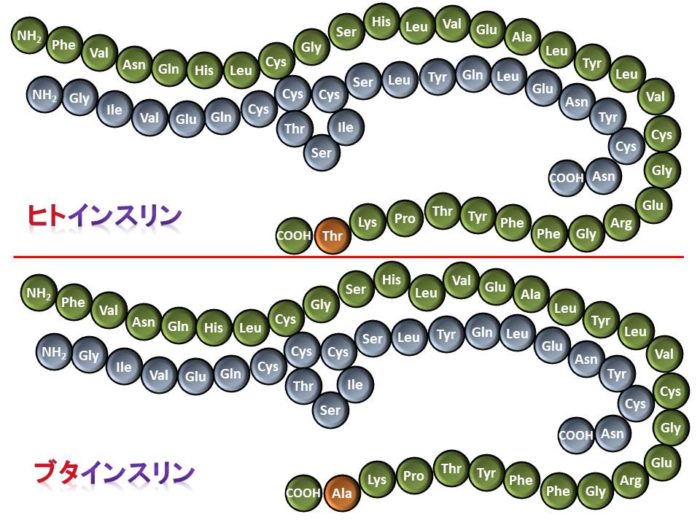
ヒトインスリンとブタインスリン
各インスリンを構成するアミノ酸のうち、オレンジ色の箇所(ヒトインスリン:Thr(トレオニン)、ブタインスリン:Ala(アラニン))が異なるのみで、とてもよく似ている。
移植する膵島を守る特殊なカプセル
バイオ人工膵島移植では、ブタ膵島を人間の身体に優しい素材で出来ているカプセルの中に封入し、移植する方法が主流です。このカプセルには、たくさん穴が開いており、膵島が生きていくための栄養素やブドウ糖、分泌されるインスリンが自由に出るような構造になっています。一方で、拒絶反応をおこすリンパ球、白血球などの免疫細胞や大きな抗体はこの穴を通ることができません。。この方法を用いれば、拒絶反応を起こさず移植後も膵島が生きていくことができ、免疫抑制剤も減らすことができるだろうと考えられています。移植後も免疫抑制剤を使わないで膵島が生きていくことができることを目指して研究を進めています。
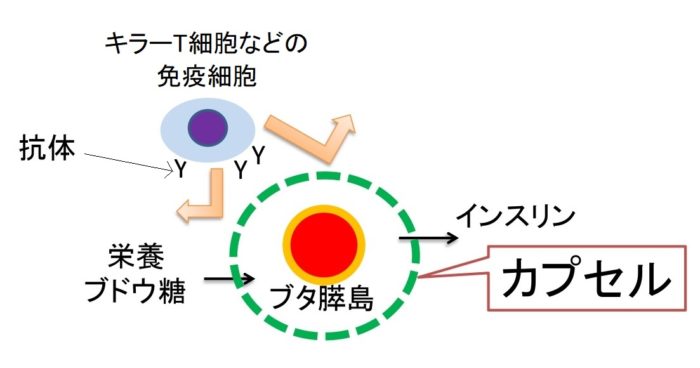
※抗体:B細胞という免疫細胞が作り出すタンパク質。体内に侵入した異物を攻撃して排除する。海外の研究で確認されたバイオ人工膵島移植の安全性と効果
2020年5月現在、バイオ人工膵島移植は、いくつかの国で既に臨床研究がおこなわれていますが、まだ標準治療となった国はありません。「ディアベセル」というブタ膵島の製剤がロシアやニュージーランド、アルゼンチンで治験が行われ、安全性と効果がある程度認められていることが発表されました。
アルゼンチンでの治験では、ウイルス・真菌のないクリーンな環境で育てられた医療用ブタから膵島を取り出して小さなカプセルに封入し、患者さんの腹腔内(横隔膜より下部で腹部の内臓が収まっている場所)に移植されました。
移植前に8%以上だったヘモグロビンA1cは、移植後2年以上に亘って平均6%台となりました。また、無自覚低血糖(自身が気がつかない危険な低血糖)の回数も減ったと発表されています。
患者さんの身体の中に移植されていたカプセルを取り出して調べた結果、膵島は生きておりインスリンやグルカゴンといったホルモンも分泌されていることが証明されました。
バイオ人工膵島移植で懸念されるのは、ブタ膵島をヒトに移植することによる感染症の伝染ですが、感染症も伝染することはなかったと発表されました。このように安全性も高く、効果も認められているバイオ人工膵島移植を日本でもできるだけ早く行いたいと考えております。
日本でのバイオ人工膵島移植実現に向けて
日本には、日本独自のルールや規制があります。2016年に厚労省の「異種移植の実施に伴う公衆衛生上の感染症問題に関する指針」が改定されました。この指針の基準を満たせば、日本でもバイオ人工膵島移植が可能になります。
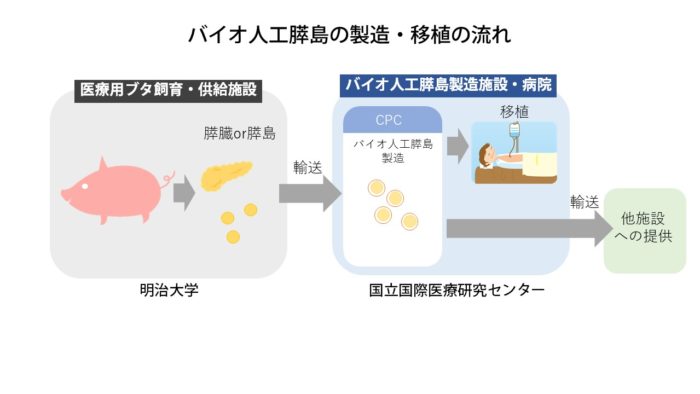
バイオ人工膵島移植の流れとしては、まず、特殊な施設で生後2~3週間の医療用ブタを手術して膵臓をとりだし、細胞加工施設(CPC)に運びます。次にCPCの中で膵島を取り出し、培養、カプセル化を行い最終的に製品化したものを品質検査と感染症の検査を行ったうえで出荷します。出荷後は、移植に使われます。国立国際医療研究センターは膵島移植の日本膵膵島移植研究会認定施設で、何例か膵島移植を行った経験もありますので、病院内で移植をすることが可能です。
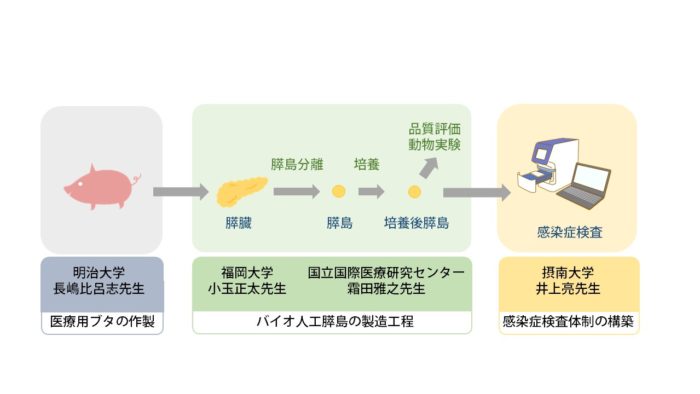
私たちのプロジェクトでは、まず明治大学で医療用ブタ(完全な無菌ブタの開発はこれからです)を開発します。福岡大学が、ブタの膵島を分離し培養をおこない、機能検査や品質評価、動物実験を経たうえでバイオ人工膵島を製造します。その後、摂南大学での感染症検査で無菌性を調べるといった工程を経ます。2019年までは、各機関で研究を進めてきましたが、2020年から各重要な工程を有機的につなげる研究を行う計画です。
質疑応答
Q:バイオ人工膵島移植の治療としての実用化は、いつ頃を考えていますか?
A:臨床研究(治療法が有効であることを確認するため、人に対して治療を行う研究)、もしくは治験(医薬品の承認申請を目的として、人に対して治療を行う研究)を2022年中に始めたいと考えております。治験の成績を見て標準治療になるかどうかを決めていきたいと思います。
Q:バイオ人工膵島移植の一番大きな課題はなんですか?
A:ブタ膵島を人間に移植するという研究が世界的に行われていますが、我々が目指しているのは再生医療としての製品化です。企業と一緒に製品化をしてバイオ人工膵島移植が保険診療となり、多くの患者さんを治療するのがゴールです。そのためには有効性、安全性、副作用がないことなどを、製品化できるレベルで証明していくことが重要だと考えております。
Q:膵島移植は腹腔内(横隔膜より下部で腹部の内臓が収まっている場所)におこなうのですか?
A:これまでも腹腔内に移植することが多く、腹腔内への移植が一番効果が高いと思われます。ただし、腹腔内にカプセルの形で移植すると、移植場所が分からなくなり、あとで回収が難しくなるといった安全性の問題が生じます。腹腔内に自由にばらまかず、胃の近くに存在する大網(だいもう)という胃から腸管の前方にある膜に移植するか脂肪の中に埋め込むなど効果的かつ安全性の高い移植場所の検討をしています。
このレポートをまとめてくださったSiddhartha Shankar Dasさんの感想
筆者は膵島移植についてもう少し調べてみました。
ヒト膵島の直径は0.1-0.5mmで、膵臓1個当たりに約100万個の膵島が存在すると言われています。膵島の直径に比べて、門脈の直径は7-15mmほどです。膵島は問題なく門脈内に生着すると考えられます。最新の研究では膵島の直径は小さい(0.05-0.1 mm)ほど生着率とインスリン分泌能力が上がることが報告されています。これは霊長類(サル)の肝臓を分析した結果です。
いつか1型糖尿病の治療としてバイオ人工膵島移植が標準治療になることと期待しています。